Technology
私たちが持っているテクノロジー
近赤外光+ハイパースペクトラルイメージング(分光画像)+AIで
見えないものを見える化する
1000-1400 nmの間に生体がよく透ける領域がある
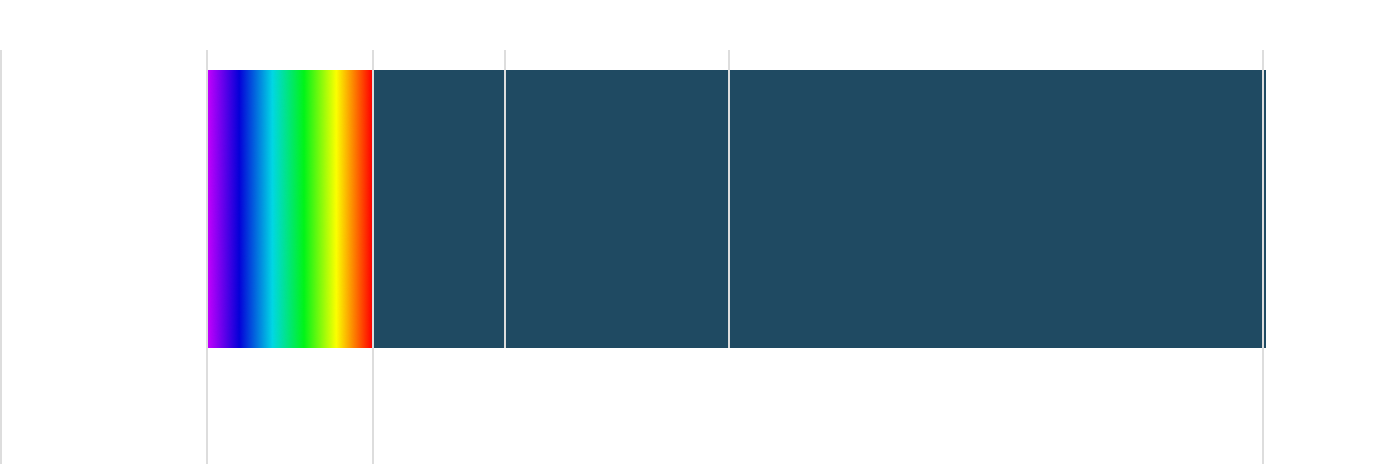
人間が普段見える光は、真ん中辺の可視光(VIS)になります。
また、生体を透過しやすい波長としては、1000nmから1400nmが“生体透過性の窓“として知られている領域です。
我々の装置では、可視光域から近赤外光域までのハイパースペクトラルイメージング(分光画像)を計測することができます。

近赤外光で見たささみ肉です。ささみ肉がある真ん中あたりでもチェッカーボードが透けて確認できると思います。
これは、近赤外光がささみ肉を通過して、下のチェッカーボードに当たり、反射した光を計測しているためです。
つまり、ある波長の近赤外光では、肉眼で見える光が反射・吸収される物体を透過する特徴があります。
(*注意:近赤外光は人間の目では見えないので、色は疑似的につけています。)
ハイパースペクトラルイメージング(HSI)分光画像
画像の1画素ごとに連続的なスペクトルの情報を持った3次元データの取得法
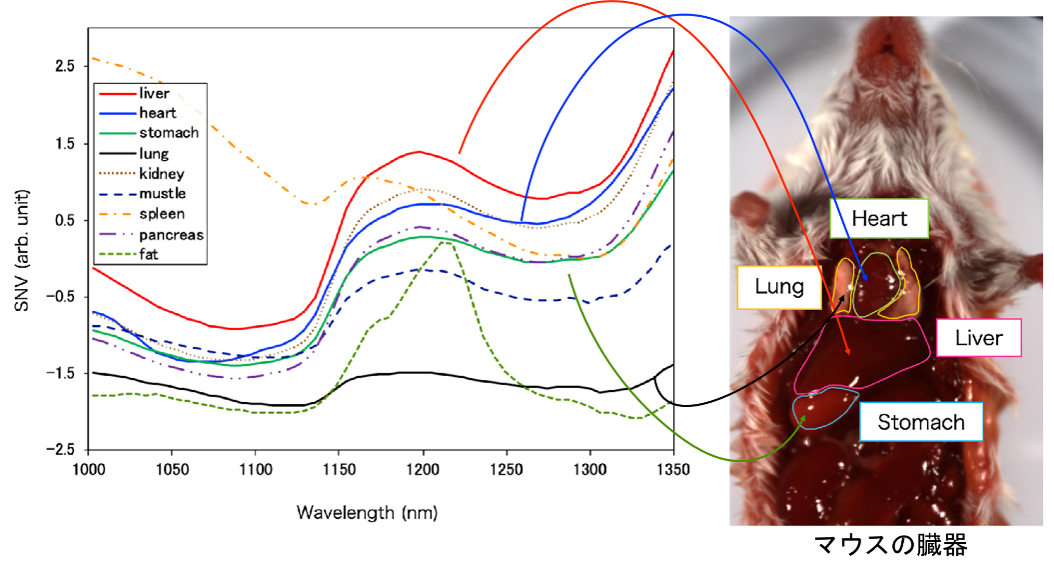
ラットのお腹を撮影した例です。各部位(例:心臓、肺、肝臓、胃)で、それぞれ吸収波長スペクトルが異なっています。
線の色は、各部位の平均吸収波長スペクトルを表しています。
各部位(例:心臓、肺、肝臓、胃)には複数の画素(ピクセル)があります。
ピクセルごとにスペクトルデータを有しています。(これがハイパースペクトラルイメージング/分光画像です。)
例えば普通のカラー画像は、1つの画素(ピクセル)はRGBの3つの値ですが、今回は100個以上の値があります。
グラフを見ると、各スペクトルが異なっていることが分かります。
AIによる自動判別
NIR-HSIは生体透過+成分分析+マッピングができる。
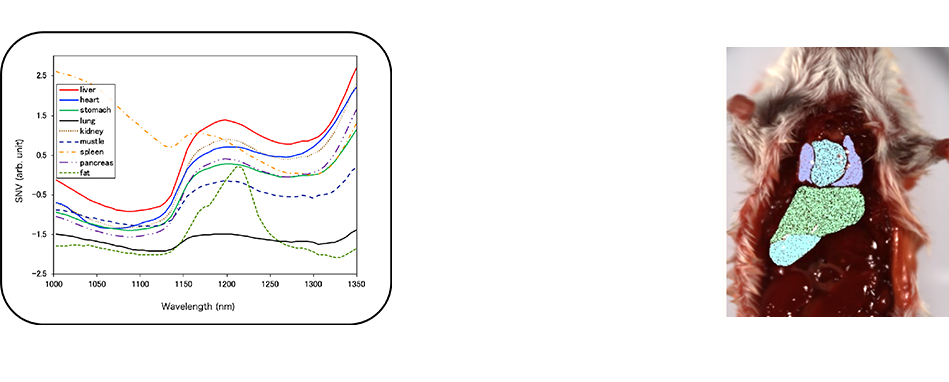
各画素(ピクセル)がそれぞれ特徴的な波長スペクトルを持っているので、
AI技術(機械学習)を用いると、識別することが可能になります。
画素(ピクセル)ごとにデータが取得できるので、AI技術とは相性がいいです。
AIで識別した結果を、元の画像の上に、重畳して表示しています。
色の違いがそれぞれの部位になります。画素(ピクセル)ごとに色分けすることができるので、識別されたことが分かります。
計測例:深部にある血管の可視化
手術時に内視鏡画像で撮影された画像から、表層から深い場所にある太い血管を可視化することができることを示す写真です。
人間が見える可視光の光(通常のカメラ)では、表層の細い血管が見えているだけで、
深部にある太い血管(青い点線)は見えていません。
近赤外光の画像では、表層の細い血管は見えませんが、深部の太い血管が浮き上がっているように見えます。
計測例:プラスチックの識別
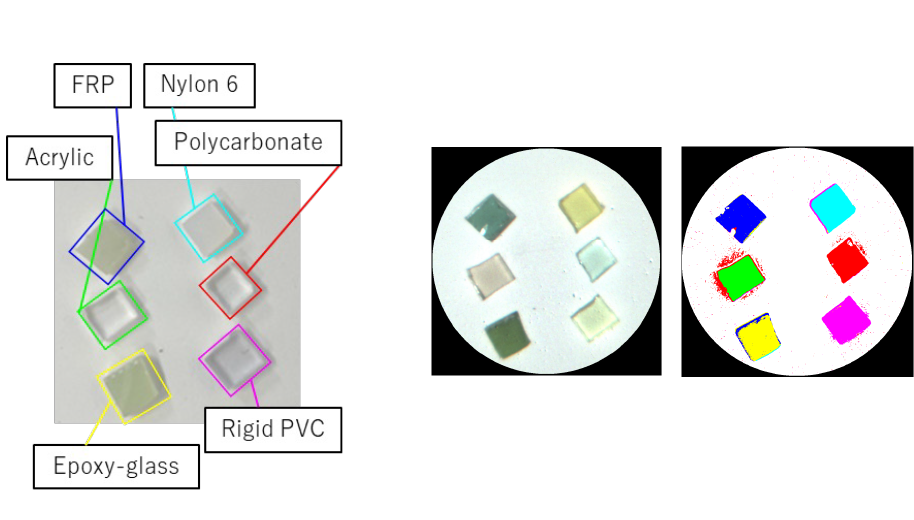
硬性内視鏡用NIR-HSIシステムで計測したプラスチックの分析の例です。
左の写真:可視画像では透明に見える6種類のプラスチックを撮影しています。
各プラスチックで波長スペクトルが異なるので、識別することができます。
右の上の写真:装置で撮影したプラスチックの近赤外画像です。(色は疑似的につています。)
右の下の写真:装置で撮影したプラスチックを機械学習によって識別しています。
色は識別したプラスチックを表しています。
可視光域から近赤外光を利用した分光画像の撮影と分析が可能です。
また、ミクロ(1mm)からマクロ(1000㎜)までの空間的範囲を撮影できる装置を開発しています。
また、細い狭い場所での撮影も可能です。
受託計測を承っています、ご興味がございましたらお気軽にお問い合わせください。
詳細を知りたい方へ
"Development of a visible and over 1000 nm hyperspectral imaging rigid-scope system using supercontinuum light and an acousto-optic tunable filter," T. Takamatsu, R. Fukushima, K. Sato, M. Umezawa, H. Yokota, K. Soga, A. Hernandez-Guedes, G. Callicó, and H. Takemura, (Optica Publishing Group, 2023). https://dx.doi.org/10.1364/opticaopen.24882405.v1(プレプリント)
概要:硬性内視鏡下で可視-近赤外(1600 nm)の波長のHSIを取得できることを報告した世界初の報告(プレプリントの公開で現在査読中)。同色樹脂を撮像,解析することによって有機分子に由来するスペクトルが抽出され,機械学習で分類できることが示された。
"Evaluating the identification of the extent of gastric cancer by over-1000 nm near-infrared hyperspectral imaging using surgical specimens," T. Mitsui, A. Mori, T. Takamatsu, T. Kadota, K. Sato, R. Fukushima, K. Okubo, M. Umezawa, H. Takemura, H. Yokota, T. Kuwata, T. Kinoshita, H. Ikematsu, T. Yano, S. Maeda and K. Soga, Journal of Biomedical Optics, 28, 8, 086001, 2023. 12 pages.https://doi.org/10.1117/1.JBO.28.8.086001
概要:胃がんの非露出を含んだ病変の可視化を検討した論文。2 mm以上の腫瘍の厚みがあると露出・非露出の病変領域を識別できることが示された。
"Wavelength Bands Reduction Method in Near-Infrared Hyperspectral Image based on Deep Neural Network for Tumor Lesion Classification," K. Akimoto, R. Ike, K. Maeda, N. Hosokawa, T. Takamatsu , K. Soga, H. Yokota, D. Sato, T. Kuwata, H. Ikematsu and H. Takemura, European Journal of Applied Sciences, 9(1), pp.273 - 281, 2021. https://doi.org/10.14738/aivp.91.9475
概要:NIR-HSIによる深部病変識別に関して機械学習の計算コストを軽減するために、波長を限定する手法に関する論文。正常粘膜の下に存在する消化管間質腫瘍の識別に関して、機械学習により有効波長を抽出することで、196波長から4波長に削減してもほとんど精度を下げずに識別できることが示された。
"Over 1000 nm Near-Infrared Multispectral Imaging System for Laparoscopic In Vivo Imaging," T. Takamatsu, Y. Kitagawa, K. Akimoto, R. Iwanami, Y. Endo, K. Takashima, K. Okubo, M. Umezawa, T. Kuwata, D. Sato, T. Kadota,T. Mitsui, H. Ikematsu, H. Yokota, K. Soga and H. Takemura, Sensors, 21, 8, 2649, 2021. https://doi.org/10.3390/s21082649
概要:1000 nm以上の波長で分光画像を取得できることを示した世界初の論文。ハロゲンランプをバンドパスフィルターの交換により、14波長の近赤外光を抽出し、担がんマウスの腫瘍部と正常部を87.8%の精度で分類できることが示された。
"Distinction of surgically resected gastrointestinal stromal tumor by near-infrared hyperspectral imaging," D. Sato, T. Takamatsu, M. Umezawa, Y. Kitagawa, K. Maeda, N. Hosokawa, K. Okubo, M. Kamimura, T. Kadota, T. Akimoto, T. Kinoshita, T. Yano, T. Kuwata, H. Ikematsu, H. Takemura, H. Yokota and K. Soga, Scientific Reports, 10, 21852, 2020. https://doi.org/10.1038/s41598-020-79021-7
概要:NIR-HSIを用いて深部の病変が識別できることを実証した世界初の論文。正常粘膜の下に存在する消化管間質腫瘍の摘出検体を用いて,NIR-HSIを行い,機械学習することで,厚み2 mm程の正常粘膜に覆われた腫瘍も80%以上の精度で識別できることが示された。